1) Calcule o trabalho em cada um dos seguintes processos, começando com uma amostra de gás em um sistema com pistão com ![]() ,
, ![]() e
e ![]() :
:
(a) expansão irreversível contra a pressão externa constante de ![]() , até o volume final
, até o volume final ![]() ;
;
(b) expansão reversível isotérmica até o volume final ![]() .
.
Resposta
(a) ![]()
(b) ![]()
2) Um gás em um cilindro foi colocado em um aquecedor e ganhou ![]() de energia na forma de calor. Se o volume do cilindro aumentou de
de energia na forma de calor. Se o volume do cilindro aumentou de ![]() para
para ![]() contra uma pressão atmosférica de
contra uma pressão atmosférica de ![]() durante o processo, qual é a variação de energia interna do gás no cilindro?
durante o processo, qual é a variação de energia interna do gás no cilindro?
Resposta
![]()
3) O difluoreto de oxigênio é um gás incolor, muito venenoso, que reage com o vapor de água para produzir ![]() ,
, ![]() e calor:
e calor:
![]()
Qual é a variação de energia interna na reação de ![]() de
de ![]() a
a ![]() ?
?
Resposta
![]()
4) Calcule a entalpia de reação da síntese do gás brometo de hidrogênio, ![]() , a partir das seguintes informações:
, a partir das seguintes informações:
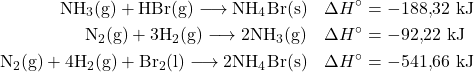
Resposta
![]()
5) Calcule a variação de entropia associada ao aumento reversível de temperatura de ![]() de um gás monoatômico ideal, de
de um gás monoatômico ideal, de ![]() até
até ![]() :
:
(a) em pressão constante
(b) em volume constante.
Resposta
(a) ![]()
(b) ![]()
6) Calcule a energia livre de Gibbs padrão da decomposição do peróxido de hidrogênioa ![]() , usando os dados abaixo:
, usando os dados abaixo:
| Substância | ||
Resposta
![]()
7) Uma mistura de reação contendo (![]() ) de (
) de (![]() ), (
), (![]() ) de (
) de (![]() ), (
), (![]() ) de (
) de (![]() ) e (
) e (![]() ) de (
) de (![]() ) foi preparada em um reator de (
) foi preparada em um reator de (![]() ). A reação:
). A reação:
![]()
atinge o equilíbrio (em ![]() ), quando (
), quando (![]() ). Qual é a concentração de cada substância no equilíbrio?
). Qual é a concentração de cada substância no equilíbrio?
Resposta
![]()
8) O processo de Claus, que é usado para remover enxofre do petróleo, na forma de dióxido de enxofre, baseia-se na reação exotérmica:
![]()
Qual é a constante de equilíbrio desta reação em ![]() ? Dadas as energias livres de Gibbs de formação do
? Dadas as energias livres de Gibbs de formação do ![]() ,
, ![]() e
e ![]() , respectivamente (em
, respectivamente (em ![]() ):
): ![]() ,
, ![]() e
e ![]() .
.
O que ocorre se:
(a) Adicionássemos gás hélio ao sistema?
(b) Diminuirmos a temperatura?
(c) Aumentássemos a pressão parcial do dióxido de enxofre?
Resposta
(a) Mesmo que o hélio contribua para o aumento da pressão total, as concentrações de equilíbrio não seriam alteradas e o equilíbrio não seria deslocado nem para reagentes nem para produtos. Só haveria deslocamento de equilíbrio por mudança de pressão se essa alteração fosse consequência de mudança do volume.
(b) Como a reação é exotérmica, o resfriamento aumenta a constante de equilíbrio, levando a um novo estado de equilíbrio mais deslocado para os produtos.
(c) O aumento da pressão parcial do ![]() é o mesmo que aumentar sua concentração, deslocando o equilíbrio no sentido de consumir esse excesso e formar mais produtos.
é o mesmo que aumentar sua concentração, deslocando o equilíbrio no sentido de consumir esse excesso e formar mais produtos.
