1) Quando o elétron excitado no átomo de hidrogênio sofre a transição ![]() , um fóton de luz azul é emitido. Se um elétron excitado no íon
, um fóton de luz azul é emitido. Se um elétron excitado no íon ![]() sofre uma transição partindo de
sofre uma transição partindo de ![]() , para qual nível de energia ele deve cair para que emita luz de mesma natureza que o átomo de
, para qual nível de energia ele deve cair para que emita luz de mesma natureza que o átomo de ![]() emitiu?
emitiu?
2) Calcule o comprimento de onda associado a uma bola de tênis de mesa de ![]() à
à ![]() . Repita o cálculo para o elétron à
. Repita o cálculo para o elétron à ![]() .
.
3) A foto-dissociação da água é equacionada por:
![]()
Essa reação tem sido sugerida como uma fonte de gás hidrogênio. Sabendo que o ![]() da reação é
da reação é ![]() , calcule o comprimento de onda máximo (em
, calcule o comprimento de onda máximo (em ![]() ) de uma radiação que apresenta esta energia.
) de uma radiação que apresenta esta energia.
4) As quatro primeiras energias de ionização de um elemento são indicadas no gráfico abaixo:
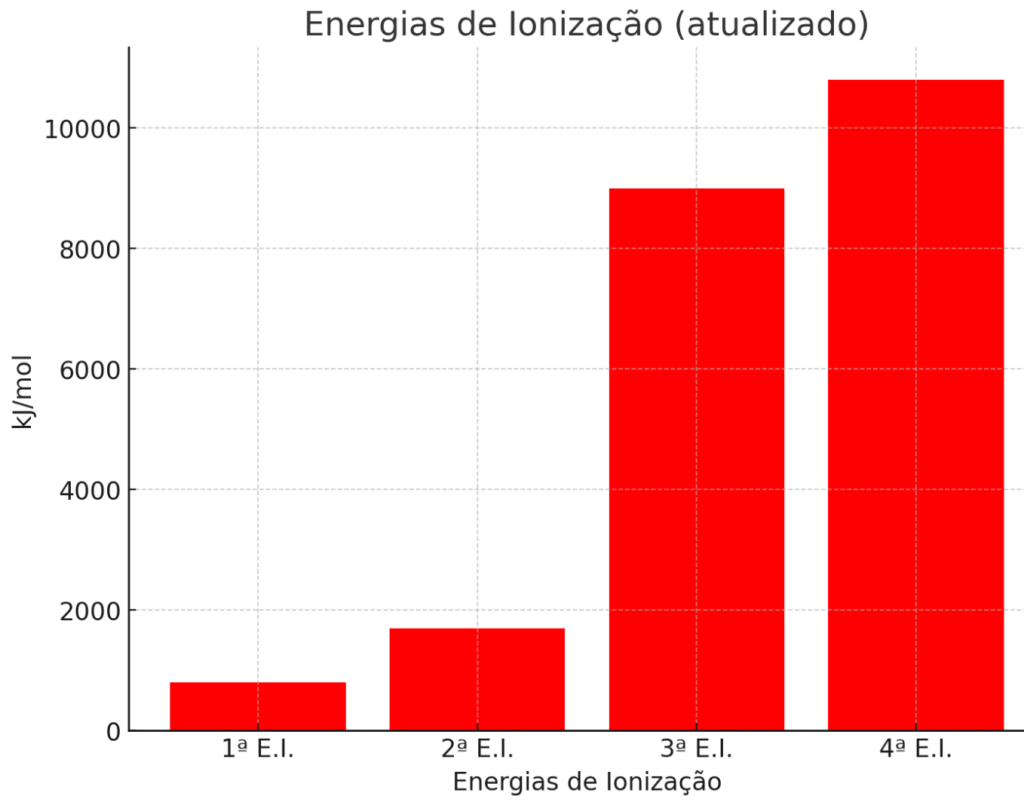
Sabendo que esse elemento é do segundo período, escreva sua configuração eletrônica.
5) A velocidade de um elétron emitido pela superfície de um metal iluminada por um fóton é ![]() .
.
(a) Qual é o comprimento de onda do elétron emitido?
(b) A superfície do metal não emite elétrons até que a radiação alcance ![]() . Quanta energia é necessária para remover o elétron da superfície do metal?
. Quanta energia é necessária para remover o elétron da superfície do metal?
(c) Qual é o comprimento de onda da radiação que causa a fotoemissão do elétron?
6) Coloque cada um dos seguintes conjuntos de elementos na ordem decrescente de energia de ionização. Explique sua escolha.
(a) enxofre, cloro, silício;
(b) cobalto, titânio, cromo;
(c) antimônio, bismuto, fósforo.
7) Escreva a estrutura de Lewis e determine a carga formal de cada átomo de
(a) ![]()
(b) ![]()
(c) ![]()
(d) ![]()
(e) ![]()
8) Utilize as estruturas de Lewis e a teoria VSEPR para dar a fórmula VSEPR e predizer a forma de cada uma das seguintes espécies:
(a) tetracloreto de enxofre;
(b) tricloreto de iodo;
(c) ![]() ;
;
(d) trióxido de xenônio;
(e) ![]() ;
;
(f) ![]() ;
;
(g) ![]() .
.
9) Usando a teoria orbital molecular, explique por que a remoção de um elétron em ![]() fortalece a ligação, enquanto a remoção de um elétron em
fortalece a ligação, enquanto a remoção de um elétron em ![]() enfraquece a ligação.
enfraquece a ligação.
