1) Uma solução formada pela mistura de ![]() de 1-propanol e certa quantidade de isopropanol a
de 1-propanol e certa quantidade de isopropanol a ![]() é regular com com parâmetro de Margules igual a
é regular com com parâmetro de Margules igual a ![]() . Constatou-se a absorção de
. Constatou-se a absorção de ![]() no processo de mistura. Calcule:
no processo de mistura. Calcule:
a) A massa de isopropanol utilizada.
b) A energia de Gibbs de mistura.
c) A atividade de cada participante.
d) A pressão de vapor da solução, a ![]() .
.
e) O coeficiente de atividade de cada participante. Comente o desvio da idealidade.
Dados:
– Pressão de vapor do 1-propanol puro a ![]() :
: ![]()
– Pressão de vapor do isopropanol puro a ![]() :
: ![]()
2) O gráfico abaixo representa as pressões parciais de vapor de cada componente em misturas de dissulfeto de carbono e acetona. Estão representados os valores reais e os previstos pela lei de Raoult.
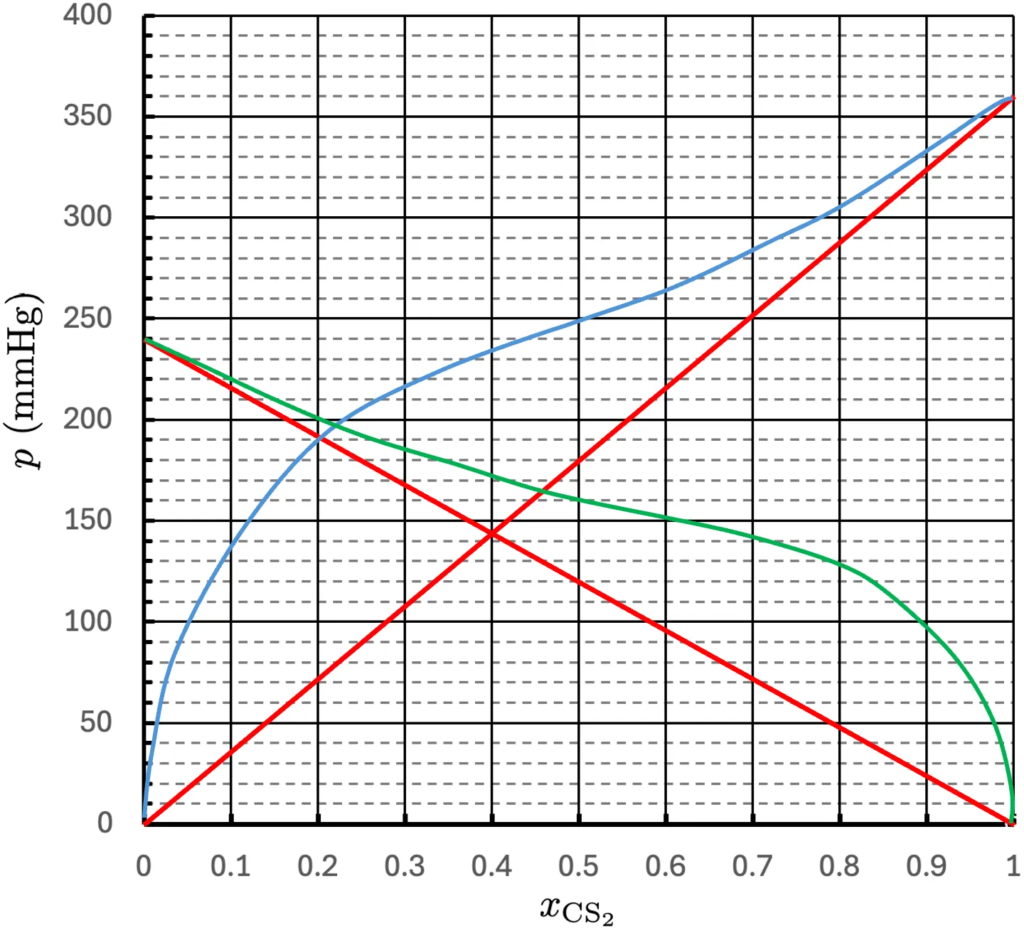
a) Qual dos componentes é mais volátil?
b) Se prepararmos uma mistura cuja massa de acetona é o triplo da massa do dissulfeto de carbono, qual será as atividades e os coeficientes de atividades de cada participante da solução?
c) Para a mesma solução do item anterior, qual é a composição do vapor?
d) Comente os desvios da idealidade.
3) Uma solução aquosa de glicose apresenta ponto de congelamento igual a ![]() na temperatura ambiente. Sabendo que a pressão de vapor da solução é
na temperatura ambiente. Sabendo que a pressão de vapor da solução é ![]() e que a constante crioscópica da água é
e que a constante crioscópica da água é ![]() , calcule a atividade e o coeficiente de atividade da água nessa solução. Considere que a pressão de vapor da água pura é
, calcule a atividade e o coeficiente de atividade da água nessa solução. Considere que a pressão de vapor da água pura é ![]() .
.
4) Experimentos envolvendo uma quantidade inicial de ![]() de água foram realizados para medir o volume da solução após a adição de diferentes quantidades de metanol. A curva abaixo é resultado do ajuste polinomial aos pontos obtidos no experimento.
de água foram realizados para medir o volume da solução após a adição de diferentes quantidades de metanol. A curva abaixo é resultado do ajuste polinomial aos pontos obtidos no experimento.
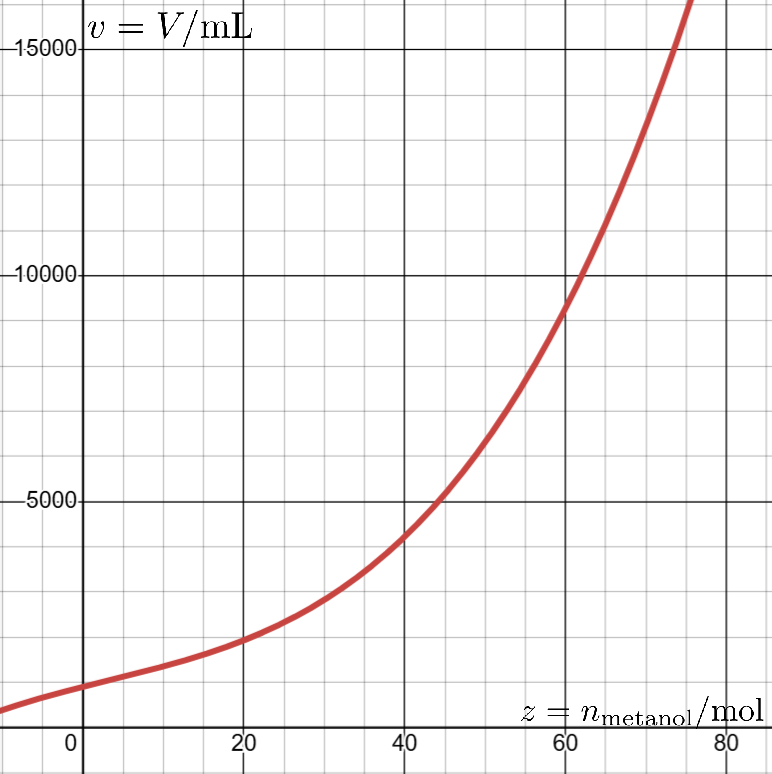
O polinômio que se ajusta aos pontos é ![]() . Calcule o volume parcial molar de metanol na solução
. Calcule o volume parcial molar de metanol na solução ![]() .
.
Dados:
– ![]()
– ![]()
5) A pressão osmótica de ![]() de uma solução contendo
de uma solução contendo ![]() de um monoálcool saturado é de
de um monoálcool saturado é de ![]() a
a ![]() . Identifique o álcool.
. Identifique o álcool.
6) O diagrama de fases da água em regiões de altas pressões é mostrado abaixo.

a) Cite os tipos de gelo que não podem sofrer fusão na faixa de ![]() e
e ![]() do gráfico.
do gráfico.
b) Calcule a variância do sistema representado pelo ponto A. Explique esse resultado.
c) Que tipo de gelo sobrevive nas condições que nós vivemos.
7) Uma solução diluída ideal de acetona e etanol apresenta pressão de vapor total igual a ![]() . Sabendo que a concentração de acetona é
. Sabendo que a concentração de acetona é ![]() e que a pressão de vapor do etanol puro é
e que a pressão de vapor do etanol puro é ![]() , calcule a constante de Henry (fictícia) para a acetona.
, calcule a constante de Henry (fictícia) para a acetona.
