1) Calcule a variação de entropia sofrida por ![]() de gás argônio, quando são aquecidos isobaricamente de
de gás argônio, quando são aquecidos isobaricamente de ![]() até
até ![]() em duas situações distintas:
em duas situações distintas:
a) Considerando o comportamento de gás monoatômico ideal.
b) Considerando que o ![]() do gás varia na faixa de temperaturas indicada de acordo com a função:
do gás varia na faixa de temperaturas indicada de acordo com a função:
![]()
Gabarito
a) ![]()
b) ![]()
2) Um mol de um gás ideal é expandido isotermicamente a ![]() até que seu volume seja triplicado.
até que seu volume seja triplicado.
Encontre os valores de ![]() ,
, ![]() e
e ![]() nas seguintes condições:
nas seguintes condições:
a) A expansão é realizada reversivelmente.
b) A expansão é realizada irreversivelmente onde ![]() de calor é menos absorvido do que em (a).
de calor é menos absorvido do que em (a).
c) A expansão é livre.
Gabarito
a) ![]() e
e ![]()
b) ![]() ,
, ![]() e
e ![]()
c) ![]() ,
, ![]() e
e ![]()
3) Calcule a variação de entropia do seguinte processo a ![]() :
:
![]()
Sabendo que a entalpia de vaporização da água é
Gabarito
![]()
4) Foi sugerido que α-cianopiridina pode ser preparada a partir de cianogênio e butadieno pela reação: ![]()
Considerando os dados termodinâmicos fornecidos abaixo, você consideraria válido tentar realizar esta reação em laboratório?
| Molécula | ||
| Butadieno (g) | ||
| Cianogênio (g) | ||
Gabarito
![]() , logo é válido tentar realizar a reação em laboratório nas condições citadas.
, logo é válido tentar realizar a reação em laboratório nas condições citadas.
5) Para a reação:
![]()
![]() e
e ![]()
Estime o valor de ![]() se
se ![]() for considerado independente da temperatura.
for considerado independente da temperatura.
Gabarito
![]()
6) Um mol de vapor é condensado reversivelmente para água líquida a ![]() e pressão de
e pressão de ![]() . O calor de vaporização da água é
. O calor de vaporização da água é ![]() . Assumindo que o vapor se comporta como um gás ideal, calcule
. Assumindo que o vapor se comporta como um gás ideal, calcule ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() e
e ![]() para o processo de condensação.
para o processo de condensação.
Gabarito
![]()
![]()
![]()
![]()
![]()
![]()
![]()
7) Sabendo que ![]() ,
, ![]() ,
, ![]() e
e ![]() , prove as relações de Maxwell:
, prove as relações de Maxwell:
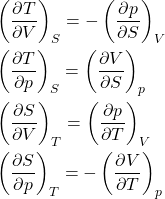
Gabarito
A demonstração foi feita em aula. Tentem sem olhar o caderno.
8) Para a reação:![]()
![]() é
é ![]() a
a ![]() . Se uma mistura inicial contendo
. Se uma mistura inicial contendo ![]() de
de ![]() e
e ![]() de
de ![]() (inerte) é passada sobre um catalisador de desidrogenação a
(inerte) é passada sobre um catalisador de desidrogenação a ![]() , qual é a composição percentual de equilíbrio da mistura gasosa efluente?
, qual é a composição percentual de equilíbrio da mistura gasosa efluente?
A pressão total é mantida em ![]() . Dado:
. Dado: ![]() a
a ![]() .
.
Calcule ![]() a
a ![]() . (Assuma
. (Assuma ![]() )
)
Gabarito
A demonstração foi feita em aula. Tentem sem olhar o caderno.
9) Para a dissociação do gás sulfeto de di-hidrogênio:
![]()
A constante de equilíbrio
a) Encontre a constante de equilíbrio padrão da reação a
b) Como o aumento na pressão afeta o equilíbrio?
c) Como a adição de um gás inerte na mistura reacional afeta o equilíbrio?
d) Como o aquecimento afeta o equilíbrio?
Gabarito
a) ![]()
b) O aumento da pressão por variação isotérmica de volume irá deslocar o equilíbrio no sentido de favorecer a formação de ![]() .
.
c) A adição de gás inerte não afeta o equilíbrio.
d) Como a reação direta é endotérmica, o aquecimento aumenta a constante de equilíbrio, de modo que o aquecimento leva a um novo estado de equilíbrio, com composição mais rica em produtos do que o original.
